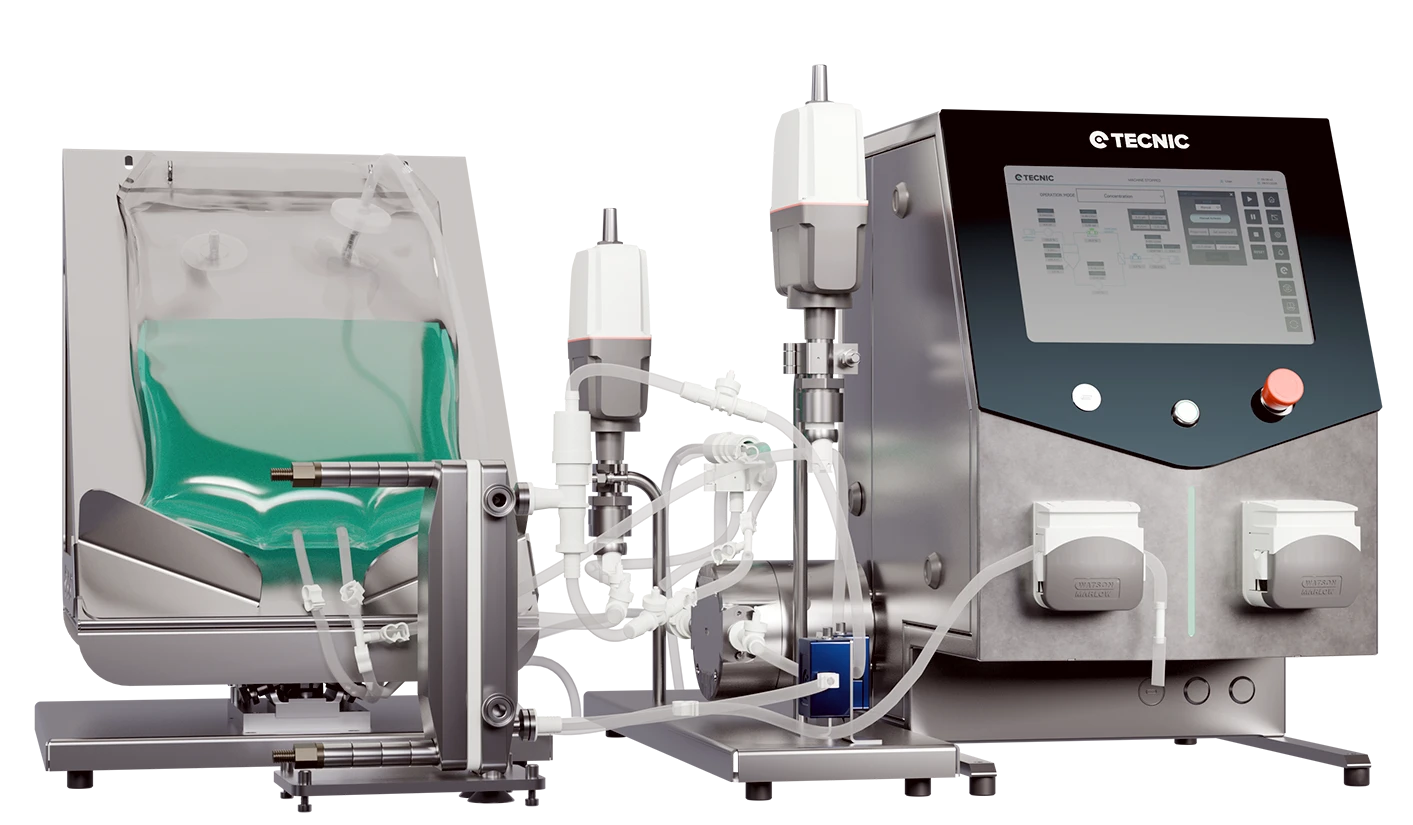
¿Qué es un biorreactor?
Un biorreactor es un recipiente o dispositivo diseñado para proporcionar un entorno controlado para el crecimiento de células vivas o microorganismos. En términos sencillos, es como un tanque especializado donde se llevan a cabo procesos biológicos (como el cultivo celular o la fermentación) en condiciones óptimas para obtener un producto deseado. Los biorreactores mantienen factores como la temperatura, el pH, el suministro de nutrientes y el oxígeno en niveles ideales, de modo que las células puedan “centrarse” en hacer su trabajo: crecer y producir compuestos específicos (como medicamentos, enzimas o productos alimentarios). Su tamaño varía desde pequeños frascos de sobremesa hasta grandes tanques industriales de miles de litros, a menudo con un diseño en acero inoxidable para garantizar durabilidad a gran escala. (Cuando se usan para fermentación microbiana, a menudo se les llama fermentadores, especialmente en la industria cervecera o en la producción de antibióticos).
Los biorreactores para cultivo celular se utilizan ampliamente en biotecnología y medicina —por ejemplo, para cultivar células animales que producen vacunas, anticuerpos o proteínas terapéuticas—. En otros casos, los biorreactores (o fermentadores) se emplean para cultivar microorganismos en procesos como la elaboración de cerveza, la fermentación de productos lácteos o la producción de biocombustibles. En esta guía básica responderemos a las preguntas más comunes sobre los biorreactores, incluyendo cómo funcionan, por qué se utilizan, cuáles son sus componentes y tipos principales (desde los reactores de tanque agitado hasta los sistemas desechables más modernos), y cómo se realiza la ampliación de procesos en biorreactores.
¿Por qué deberías considerar el uso de un biorreactor?
El cultivo de células en un biorreactor ofrece varias ventajas frente a los métodos tradicionales (como los matraces de agitación o las placas de Petri en una incubadora). Los biorreactores están diseñados para crear condiciones de crecimiento óptimas y superar las limitaciones de las técnicas de cultivo más simples. Algunas de las principales ventajas de utilizar biorreactores son:
Mayor rendimiento celular (escalabilidad): los biorreactores son escalables, lo que significa que se puede aumentar el volumen de cultivo en un solo recipiente en lugar de utilizar decenas de matraces pequeños. Un biorreactor de tanque agitado puede trabajar con volúmenes de miles de litros, mientras que los matraces de agitación convencionales suelen limitarse a unos pocos litros. Esto hace que escalar un proceso en biorreactor sea mucho más eficiente para producir grandes cantidades de células o productos en una sola operación.
Mejor control y consistencia: los biorreactores supervisan y regulan en tiempo real parámetros críticos como el pH, la temperatura, el oxígeno disuelto y los niveles de nutrientes mediante sensores integrados y sistemas de control automatizados. En un matraz simple, normalmente solo se controla la temperatura (a través de la incubadora), pero un biorreactor puede ajustar automáticamente las condiciones, por ejemplo, añadiendo oxígeno o nutrientes para mantener las células en condiciones óptimas. Esto se traduce en un crecimiento más constante y en una menor variabilidad entre lotes en cuanto a la calidad del producto. Cada lote tiene así más probabilidades de éxito porque el entorno se mantiene estable y reproducible.
Optimización e investigación más rápidas: los sistemas de biorreactores modernos permiten ejecutar múltiples cultivos pequeños en paralelo, lo que resulta ideal para probar distintas condiciones de forma rápida. Los científicos pueden experimentar con parámetros variables (como el pH o la velocidad de alimentación) simultáneamente en biorreactores en miniatura para encontrar la mejor combinación para el crecimiento celular o la producción. Este enfoque de alto rendimiento ahorra tiempo en el desarrollo de procesos en comparación con trabajar con un solo matraz cada vez.
En resumen, los biorreactores permiten el cultivo a gran escala con un control ambiental preciso, mejorando el rendimiento y la consistencia. Actúan como puente entre el laboratorio y la producción industrial al crear condiciones difíciles de alcanzar con matraces de agitación o placas de Petri. Además, los biorreactores ofrecen un sistema cerrado y estéril, lo que reduce el riesgo de contaminación y permite cultivar células durante más tiempo o alcanzar densidades celulares más altas que en cultivos abiertos.
¿Cuáles son los principales componentes de un biorreactor?
Aunque los biorreactores pueden tener muchos diseños diferentes, la mayoría comparte un conjunto de componentes fundamentales que permiten mantener un entorno adecuado para el crecimiento celular. Centrándonos en el biorreactor de tanque agitado, el modelo más habitual en laboratorios e industrias, los elementos clave son:
Recipiente (tanque): Es el contenedor principal que alberga el caldo de cultivo (células más medio nutritivo). Suele ser un tanque cilíndrico diseñado para ser hermético y estéril. Puede estar fabricado en acero inoxidable, vidrio o plástico, según el tamaño y el uso. Los biorreactores industriales suelen utilizar recipientes de acero inoxidable por su durabilidad, facilidad de limpieza y mantenimiento de la esterilidad. En escala de laboratorio, se emplean unidades de vidrio o revestimientos plásticos de un solo uso. El recipiente suele incorporar una camisa de calefacción/refrigeración o serpentines para regular la temperatura.
Sistema de agitación (impulsor): La mayoría de los biorreactores cuentan con un agitador mecánico, normalmente un impulsor (una pala o hélice giratoria) montado en un eje y accionado por un motor situado en la parte superior o inferior del recipiente. El impulsor agita el cultivo líquido, mezclando de forma uniforme los nutrientes, los gases y las células. Una agitación adecuada garantiza que todas las células reciban el mismo acceso al alimento y al oxígeno, y evita la formación de gradientes de temperatura dentro del tanque. Pueden incluirse deflectores (placas fijas en las paredes del recipiente) para mejorar la mezcla. La velocidad de agitación (RPM) se puede ajustar según las necesidades del organismo: por ejemplo, los cultivos microbianos suelen tolerar agitaciones más rápidas que las células mamíferas, que son más frágiles.
Sistema de aireación (sparger): Las células que requieren oxígeno (es decir, la mayoría de los cultivos, salvo los anaerobios estrictos) necesitan un suministro constante de gas. El sparger es un dispositivo de entrada de aire (u oxígeno), normalmente en forma de anillo o tubo con orificios finos, situado en el fondo del recipiente. Su función es introducir aire u oxígeno en el cultivo en forma de burbujas pequeñas. Estas burbujas proporcionan oxígeno a las células y ayudan a eliminar el dióxido de carbono. La combinación de la aireación (burbujeo) y la agitación permite maximizar el intercambio gaseoso en el medio líquido. En algunos sistemas (como los biorreactores de aire elevador), la aireación también contribuye a mezclar el cultivo.
Control de temperatura: Los biorreactores deben mantener el cultivo a la temperatura adecuada para las células (por ejemplo, 37 °C para células humanas o alrededor de 30 °C para levaduras). La temperatura se regula mediante sistemas integrados como camisas de calefacción/refrigeración alrededor del recipiente o serpentines internos por los que circula agua a temperatura controlada. Sensores específicos miden la temperatura de forma continua, y el sistema de control activa o desactiva los calentadores o enfriadores para mantener el valor fijado. Mantener una temperatura estable es fundamental, ya que incluso pequeñas variaciones pueden afectar al crecimiento celular y a la producción del compuesto deseado.
Sensores y sistema de control: Un biorreactor moderno está equipado con diversos sensores que monitorizan las condiciones dentro del recipiente. Por ejemplo, sondas que miden el pH (acidez), el oxígeno disuelto (nivel de O₂ en el líquido) y, en algunos casos, la densidad celular o la concentración de glucosa. También suelen incluirse sensores de espuma y de nivel. Todas estas mediciones se envían a un sistema de control (un ordenador o unidad de control) que ajusta automáticamente los parámetros para mantener las condiciones óptimas.
Por ejemplo, si el pH disminuye debido a la producción de subproductos ácidos por parte de las células, una bomba puede añadir una base para neutralizarlo; o si el nivel de oxígeno es bajo, el sistema puede aumentar el flujo de aire o la velocidad de agitación. Este bucle de retroalimentación permite que el biorreactor mantenga un entorno estable (homeostasis) para el cultivo. Los operadores pueden establecer los valores deseados (setpoints) y el biorreactor se encarga de gestionarlos de forma automática, registrando a menudo los datos para su análisis posterior.
Esterilidad y conexiones: Los biorreactores están diseñados para funcionar de forma aséptica, lo que significa que deben evitar la contaminación por microorganismos no deseados. Los recipientes cuentan con puertos o conexiones selladas para añadir líquidos (como nutrientes o soluciones ácidas/básicas para el control del pH), tomar muestras del cultivo o recolectar el producto, todo ello sin permitir la entrada de contaminantes. Los biorreactores de acero inoxidable de gran tamaño suelen estar equipados con sistemas de esterilización, y pueden ser esterilizados con vapor in situ entre lotes.
En cambio, los biorreactores de un solo uso vienen preesterilizados (mediante irradiación gamma) y se desechan tras su uso, lo que elimina la necesidad de limpieza o esterilización entre lotes. Muchos modelos también incorporan mecanismos de control de espuma (como un sensor y la adición automática de antiespumante), ya que la aireación y la agitación pueden generar espuma que debe controlarse para evitar que se desborde o bloquee las salidas de gases.

¿Qué tipos de biorreactores existen?
Existen distintos tipos y diseños de biorreactores para adaptarse a diferentes organismos y procesos. El biorreactor de tanque agitado (STR), que describimos anteriormente, es el diseño más común: un tanque cilíndrico con agitación mecánica. Sin embargo, en situaciones específicas se utilizan otras configuraciones. A continuación, se presentan algunos tipos comunes de biorreactores y sus características:
Biorreactores de tanque agitado (STR): Este es el diseño estándar de biorreactor y se utiliza ampliamente en diversas industrias. Consiste en un tanque (normalmente cilíndrico) con un impulsor para mezclar el cultivo. Los STR ofrecen un excelente control de los parámetros ambientales (temperatura, pH, oxígeno, etc.) y son muy versátiles. Se utilizan en procesos que van desde fermentaciones microbianas (por ejemplo, para producir antibióticos y enzimas) hasta cultivos de células de mamífero para la producción biofarmacéutica. En términos de ingeniería química, un STR es similar a un reactor de tanque agitado, y puede operarse en modos discontinuo, fed-batch o continuo.
Biorreactores de aire elevador (Airlift): En este tipo de biorreactor no existe un eje mecánico de agitación; en su lugar, la mezcla se consigue introduciendo aire (u otro gas) en la base del reactor. Las burbujas de gas que ascienden generan un flujo de líquido en circulación que agita el cultivo. Este diseño ejerce un menor esfuerzo de cizalla sobre las células en comparación con un impulsor, lo cual es beneficioso para células frágiles (por ejemplo, muchos cultivos de células mamíferas son sensibles a una agitación excesiva). Los biorreactores de aire elevador suelen incorporar un tubo interno de circulación para dirigir el flujo. Se utilizan habitualmente para cultivar células destinadas a vacunas o ingeniería de tejidos, donde se requiere un manejo delicado.
Fotobiorreactores: Estos biorreactores están especializados en organismos fotosintéticos como las algas o las cianobacterias. Un fotobiorreactor incorpora una fuente de luz además de los controles habituales de un biorreactor. Su diseño puede ser tubular (con tubos transparentes), de panel plano o columnar, con el objetivo de maximizar la superficie expuesta a la luz. Las algas cultivadas en fotobiorreactores pueden captar CO₂ y convertirlo en biomasa, y se utilizan para producir biocombustibles, suplementos nutricionales y otros compuestos de valor como pigmentos o ácidos grasos omega-3. Los fotobiorreactores deben equilibrar la iluminación con la mezcla y el intercambio de gases, y a menudo requieren control de temperatura debido al calor generado por las fuentes de luz.
Biorreactores de lecho fijo (Packed-Bed): En un biorreactor de lecho fijo, las células o enzimas están inmovilizadas sobre un material sólido de soporte (como perlas, fibras o resinas porosas) que se encuentra empaquetado en una columna o recipiente. El medio nutritivo fluye a través del lecho, suministrando nutrientes a las células inmovilizadas y arrastrando los productos generados. Esta configuración permite alcanzar densidades celulares muy elevadas y tiempos de reacción prolongados, ya que las células permanecen retenidas en el reactor.
Los biorreactores de lecho fijo se utilizan, por ejemplo, en reacciones enzimáticas, ciertos procesos de fermentación o para cultivar células vegetales que se adhieren a matrices de soporte. Suelen funcionar en modo continuo (entrada de medio fresco y salida de producto). Un diseño relacionado es el biorreactor de lecho fluidizado, en el que las partículas están suspendidas y se mezclan mediante el flujo de líquido o gas.
| Tipo de biorreactor | Mezcla / Funcionamiento | Principales ventajas | Aplicaciones típicas |
|---|---|---|---|
| Biorreactor de tanque agitado | El impulsor mecánico agita el cultivo | Excelente control de la temperatura, el pH y el oxígeno; modos de funcionamiento versátiles (por lotes, alimentado por lotes, continuo) | Fermentaciones microbianas (antibióticos, enzimas); cultivo de células de mamíferos para biofarmacia |
| Biorreactor Airlift | La inyección de gas impulsa la circulación (sin eje) | Baja tensión de cizallamiento; suave con las células frágiles | Producción de vacunas; ingeniería de tejidos; cultivos de células de mamíferos delicados |
| Fotobiorreactor | Suministro de luz + mezcla e intercambio de gases | Permite la fotosíntesis; luz y temperatura controladas | Fermentaciones microbianas (antibióticos, enzimas); cultivo de células de mamíferos para biofarmacia |
| Biorreactor de lecho compacto | El medio fluye a través de un soporte inmovilizado | Densidad celular muy alta; tiempos de residencia largos | Reacciones enzimáticas; determinadas fermentaciones; suspensiones de células vegetales |
¿Cuál es la diferencia entre los biorreactores de un solo uso y los de acero inoxidable?
En los procesos bioindustriales modernos, existen dos grandes categorías de biorreactores: los biorreactores tradicionales de acero inoxidable (fabricados en metal rígido, diseñados para ser limpiados y reutilizados durante años) y los biorreactores de un solo uso (hechos con bolsas o revestimientos plásticos desechables, pensados para un solo uso o para una campaña específica). Ambos tipos pueden funcionar de manera similar en el cultivo celular, pero presentan diferencias importantes:
Materiales y reutilización: Los biorreactores de acero inoxidable son recipientes duraderos y permanentes que deben limpiarse y esterilizarse entre lotes (a menudo mediante ciclos automatizados de limpieza y esterilización in situ). En cambio, los sistemas de un solo uso emplean bolsas o contenedores de plástico preesterilizados como recipiente de cultivo, que se desechan tras su utilización. Esto significa que los sistemas de un solo uso no requieren largos procedimientos de limpieza o esterilización: basta con instalar una bolsa estéril nueva para cada ciclo.
Escala y capacidad: Los biorreactores de acero inoxidable predominan en escalas muy grandes: pueden construirse con capacidades de entre 10.000 y 20.000 litros o más, pensados para lotes de producción masiva. Los biorreactores de un solo uso suelen tener un volumen de trabajo de hasta unos 2.000 litros (aunque algunos diseños más recientes alcanzan los \~5.000 litros). Los procesos con densidades celulares muy altas pueden compensar en parte esta limitación de volumen, pero en general se prefiere el acero inoxidable para la fabricación a gran escala, como en la producción de medicamentos de alto volumen.
Tiempo de cambio y flexibilidad: Los biorreactores de un solo uso permiten un cambio más rápido entre lotes, ya que se elimina la etapa de limpieza y esterilización: basta con colocar un nuevo revestimiento estéril e iniciar el siguiente ciclo. Esta rotación rápida es ideal para instalaciones multiproducto o producción clínica ágil, y reduce los tiempos de inactividad. Los sistemas de acero inoxidable, en cambio, requieren más tiempo entre lotes debido a la limpieza, y necesitan servicios auxiliares (vapor, agua) para llevarla a cabo. No obstante, el acero inoxidable puede ser más adecuado para ciertos procesos (por ejemplo, fermentaciones microbianas con condiciones agresivas) y no depende del suministro de bolsas desechables.
Contaminación y validación: La tecnología de un solo uso puede reducir el riesgo de contaminación cruzada, ya que cada lote utiliza una superficie de contacto estéril completamente nueva. Al desechar la bolsa tras su uso, no existe riesgo de arrastre de residuos del lote anterior. En cambio, los biorreactores de acero inoxidable requieren una validación rigurosa de la limpieza para garantizar que no queden contaminantes ni restos de producto. Por otro lado, los plásticos de un solo uso deben someterse a pruebas de lixiviables y extraíbles (sustancias químicas que podrían desprenderse del plástico hacia el cultivo) como parte del proceso de validación, un problema que no afecta a los recipientes de acero.
Costes y residuos: Un biorreactor de acero inoxidable implica una inversión inicial elevada para su instalación, además de costes continuos asociados a productos de limpieza, consumo de agua, energía y mantenimiento. Los biorreactores de un solo uso, en cambio, suelen tener un coste inicial más bajo y se pueden implementar más rápidamente (no requieren tuberías complejas ni sistemas CIP), pero generan costes recurrentes más altos por el uso de bolsas desechables, filtros y componentes plásticos en cada ciclo.
Desde una perspectiva medioambiental, los sistemas de un solo uso generan una gran cantidad de residuos plásticos, mientras que los sistemas de acero inoxidable producen aguas residuales y desechos químicos derivados de los procesos de limpieza. La comparación en términos de sostenibilidad es compleja: los sistemas de un solo uso ahorran agua y energía al eliminar la limpieza, pero generan residuos plásticos biopeligrosos que deben gestionarse adecuadamente.
En la práctica, la elección entre un sistema de un solo uso y uno de acero inoxidable depende del contexto: muchas instalaciones biotecnológicas nuevas optan por sistemas de un solo uso por su flexibilidad (especialmente en procesos de hasta 2000 L o en líneas multiproducto), mientras que la producción a gran escala de un único producto (por ejemplo, una vacuna de alta demanda) puede seguir utilizando grandes tanques de acero inoxidable. Algunas plantas incluso adoptan un enfoque híbrido, combinando biorreactores desechables en ciertas etapas y de acero en otras, para aprovechar las ventajas de ambos. La buena noticia es que, desde el punto de vista del usuario, el funcionamiento de un biorreactor de un solo uso o uno de acero inoxidable es muy similar: las células no notan la diferencia, siempre que el sistema de control mantenga las condiciones adecuadas.
¿Qué tipos de células pueden cultivarse en biorreactores?
Los biorreactores son herramientas versátiles que permiten cultivar muchos tipos de células diferentes. Cualquier célula que se beneficie de un entorno controlado puede ser una candidata. En general, los biorreactores se utilizan para el cultivo de microorganismos (como bacterias, levaduras y hongos), células animales (como las mamíferas o de insecto), así como ciertas células vegetales e incluso algas. A continuación se presentan algunas de las principales categorías de tipos celulares que se cultivan en biorreactores:
Células microbianas (bacterias y levaduras): Una gran parte de los bioprocesos industriales involucra cultivos microbianos. Las bacterias (por ejemplo, E. coli) y las levaduras (como Saccharomyces cerevisiae) crecen rápidamente y suelen fermentarse en biorreactores para producir productos como insulina, enzimas, aminoácidos, etanol, antibióticos y muchos más. Numerosos alimentos y bebidas se elaboran mediante biorreactores microbianos; por ejemplo, la levadura fermenta azúcares para producir cerveza y vino, y los cultivos bacterianos se utilizan para fabricar yogur y queso. Las células microbianas suelen tolerar condiciones intensas, como altas velocidades de agitación y tasas de aireación, y los fermentadores microbianos estuvieron entre los primeros biorreactores desarrollados a gran escala.
Células animales (cultivos de células mamíferas e insecto): Los biorreactores son fundamentales para el cultivo de células mamíferas más complejas —como las células CHO (de ovario de hámster chino), las HEK 293 o incluso células inmunitarias humanas—, especialmente en la industria biofarmacéutica. Estas células son capaces de producir proteínas terapéuticas complejas como anticuerpos monoclonales, hormonas (por ejemplo, eritropoyetina) o vacunas que las bacterias no pueden sintetizar correctamente. Dado que las células mamíferas son delicadas y requieren condiciones muy específicas (37 °C, control preciso de oxígeno y pH, factores de crecimiento, etc.), los biorreactores proporcionan el entorno estable necesario para su cultivo.
Las células de insecto (como las líneas celulares Sf9 o Sf21, utilizadas con el sistema de expresión baculovirus) también se cultivan en biorreactores para producir vacunas (por ejemplo, algunas vacunas contra la gripe) o vectores para terapia génica. Los biorreactores permiten cultivar estas células animales en suspensión y a gran escala, con mezclado y aireación controlados, utilizando habitualmente impulsores más suaves o spargers especializados para adaptarse a su sensibilidad.
Células vegetales y algas: Aunque pueda sorprender, las suspensiones de células vegetales también pueden cultivarse en biorreactores. Estos cultivos se utilizan para producir metabolitos secundarios (como compuestos farmacéuticos, aromas o colorantes) que las plantas generan en pequeñas cantidades. Por ejemplo, precursores de fármacos anticancerígenos o del aroma de vainilla pueden obtenerse a partir de células vegetales en un biorreactor. Las algas (plantas unicelulares) se cultivan en fotobiorreactores para generar biomasa destinada a biocombustibles o compuestos de alto valor, como ácidos grasos omega-3 y pigmentos.
Estos cultivos fotosintéticos necesitan luz además de los controles habituales de nutrientes y condiciones ambientales. El cultivo de células vegetales y algas en biorreactores permite aprovechar su capacidad bioquímica a escala industrial, en condiciones estériles y controladas (a diferencia del cultivo de algas en estanques abiertos, donde la contaminación y el clima pueden suponer un problema).
En resumen, los biorreactores para cultivo celular pueden manejar desde microbios diminutos hasta células eucariotas más complejas. Los investigadores incluso los utilizan para cultivar tejidos o células madre en medicina regenerativa. La elección del tipo de biorreactor (tanque agitado, agitación por ondas, etc.) puede variar según el tipo celular (por ejemplo, las células mamíferas suelen requerir una agitación más suave y medios especializados). Pero en general, si necesitas cultivar una gran cantidad de cualquier tipo de célula de forma segura y eficiente, el biorreactor es la herramienta adecuada.
| Tipos de células | Ejemplos | Condiciones de cultivo | Productos típicos | Formatos de biorreactores |
|---|---|---|---|---|
| Células microbianas | E. coli, S. cerevisiae, hongos | 20-37 °C; alta agitación y aireación | Insulina, enzimas, aminoácidos, etanol, yogur, cerveza | Fermentador de tanque agitado |
| Células de mamífero | CHO, HEK 293, células inmunitarias humanas | 37 °C; baja cizalladura; pH preciso, control DO | Anticuerpos monoclonales, vacunas, hormonas | STR de un solo uso o de acero inoxidable |
| Células de insecto | Sf9, Sf21 (sistema de baculovirus) | ~27 °C; mezcla suave; factores de crecimiento | VLPs, proteínas recombinantes, factores de crecimiento | Airlift o impulsor suave STR |
| Células vegetales | Nicotiana sp., Cinchona sp. | 25-30 °C; mezcla moderada; ciclos oscuridad/luz | Metabolitos secundarios, vacunas | STR o lecho compacto |
| Algas | Chlorella, Spirulina | Suministro de luz + CO₂; mezcla moderada | Pigmentos, biocombustibles, suplementos dietéticos | Fotobiorreactor |
¿Cuáles son las aplicaciones típicas de los biorreactores?
Los biorreactores se han vuelto indispensables en múltiples sectores. A continuación se presentan algunas de las principales áreas de aplicación y ejemplos de para qué se utilizan en cada una:
Farmacéutica y Biotecnología (Medicina): Probablemente el uso más conocido de los biorreactores sea la producción de biofármacos, es decir, productos médicos elaborados por células vivas. Esto incluye la fabricación de anticuerpos monoclonales, proteínas terapéuticas (como la insulina o los factores de crecimiento), vacunas (incluidas las vacunas modernas basadas en cultivo celular), vectores para terapia génica y productos para terapias celulares.
Las compañías farmacéuticas cultivan células mamíferas o de insecto en grandes biorreactores para producir estos medicamentos biológicos complejos en grandes volúmenes. Los biorreactores también se utilizan en investigación y desarrollo para escalar procesos prometedores basados en células desde el laboratorio hasta fases piloto. En el campo emergente de la medicina regenerativa, los biorreactores pueden facilitar el crecimiento de tejidos o células cultivadas con fines terapéuticos (por ejemplo, el cultivo de células CAR-T para el tratamiento del cáncer).
Alimentación y bebidas: Mucho antes de que existiera el término “biorreactor”, ya se utilizaban grandes recipientes para fermentar alimentos y bebidas —que, en esencia, ya eran biorreactores—. Hoy en día, la industria alimentaria utiliza biorreactores (a menudo denominados fermentadores) en procesos como la elaboración de cerveza, vino, productos lácteos fermentados (yogur, kéfir), vinagre y panificación (donde la levadura fermenta la masa).
Por ejemplo, las cervecerías modernas utilizan tanques de fermentación de acero inoxidable con control preciso de temperatura, que son biorreactores optimizados para el crecimiento de levaduras. Además, los biorreactores se emplean en la producción de aditivos alimentarios como aminoácidos, vitaminas, compuestos aromáticos y enzimas mediante fermentación microbiana. Un área emergente muy prometedora es la de la carne cultivada, donde células musculares animales se cultivan en biorreactores para producir carne sin necesidad de criar animales. Aunque esta tecnología aún está en desarrollo, los primeros prototipos de carne y proteínas lácteas cultivadas dependen del cultivo celular en biorreactores.
Biotecnología industrial (químicos y biocombustibles): Los biorreactores se utilizan para fabricar una amplia variedad de compuestos químicos de origen biológico. Por ejemplo, se cultivan ciertos microorganismos para producir biocombustibles como etanol y biodiésel (a partir de algas o levaduras) en grandes tanques de fermentación. También se emplean en la producción de biopolímeros (plásticos biodegradables como el PLA o el PHB obtenidos por fermentación bacteriana) y productos químicos de plataforma (componentes químicos básicos como ácido cítrico, ácido láctico o aminoácidos) a granel.
Estos procesos aprovechan microorganismos capaces de convertir azúcares u otras materias primas en compuestos químicos de valor dentro de biorreactores. En comparación con la síntesis química tradicional, los bioprocesos pueden ser en algunos casos más sostenibles y utilizar recursos renovables. Los biorreactores son fundamentales para escalar estos procesos microbianos a nivel industrial.
Aplicaciones medioambientales: Los biorreactores también desempeñan un papel importante en la gestión ambiental. En el tratamiento de aguas residuales, por ejemplo, microorganismos presentes en biorreactores descomponen aguas negras o residuos industriales. Existen biorreactores especializados como los tanques de lodos activados, biofiltros o digestores anaerobios, que depuran el agua mediante la biodegradación de contaminantes. Un ejemplo común es el biorreactor de filtro percolador, donde el agua residual gotea sobre un lecho de rocas o material plástico recubierto de biopelícula, y los microorganismos digieren los residuos al pasar. Los biorreactores anaerobios (tanques sellados sin oxígeno) también se utilizan para tratar residuos orgánicos y generar biogás (metano).
Otro uso medioambiental es la biorremediación, donde los biorreactores se emplean para cultivar bacterias u hongos capaces de consumir compuestos tóxicos (como en la limpieza de vertidos de petróleo o residuos químicos dentro de un reactor controlado). Estas aplicaciones demuestran que los biorreactores no solo sirven para producir compuestos, sino también para eliminar o transformar sustancias no deseadas de forma respetuosa con el medio ambiente.
Como muestran estos ejemplos, los biorreactores están en el centro de los bioprocesos modernos en sectores muy diversos: desde la fabricación de medicamentos que salvan vidas y combustibles sostenibles, hasta la elaboración de cerveza o el tratamiento de residuos. Siempre que se aprovecha la biología a gran escala, casi siempre hay un biorreactor implicado.

¿A qué escalas de producción se pueden utilizar los biorreactores?
Los biorreactores se utilizan en múltiples escalas de producción, desde pequeños experimentos de laboratorio hasta la fabricación a escala industrial. Funcionan como una tecnología escalable: un proceso que funciona en un biorreactor pequeño suele poder ampliarse a volúmenes mayores (con la ingeniería adecuada). Normalmente, se distinguen las siguientes escalas de biorreactores:
Escala pequeña (escala de laboratorio): Los microbiorreactores o biorreactores de sobremesa, con volúmenes de trabajo de entre 0,1 y 1 litro (a menudo alrededor de 100 mL), se utilizan en investigación y desarrollo, así como en las primeras fases de desarrollo de procesos. En esta escala, los investigadores exploran condiciones y evalúan la viabilidad del cultivo. Incluso existen microbioreactores que contienen solo unos pocos mililitros, empleados para el cribado de cultivos a gran rendimiento. Estos sistemas imitan el funcionamiento de los biorreactores mayores, pero en formato miniatura.
Escala intermedia (escala de laboratorio/piloto): Los biorreactores con volúmenes en el rango de los litros (por ejemplo, 1 L, 5 L, 10 L, hasta unos 50 L) se utilizan para estudios más detallados y producción piloto. En esta escala, los científicos suelen perfeccionar el proceso y recopilar datos clave para su futura ampliación. También pueden producir pequeños lotes de un producto para pruebas. Los laboratorios académicos e industriales suelen contar con biorreactores de tanque agitado a escala banco, modulares y altamente instrumentados, que permiten experimentar antes de escalar a mayores volúmenes.
Escala de producción (escala industrial): Los biorreactores de gran tamaño tienen volúmenes de trabajo que van desde cientos hasta miles de litros. Se utilizan en instalaciones de fabricación. Por ejemplo, un biorreactor de producción para un biofármaco comercial puede tener un volumen de 1.000 L, 5.000 L o incluso 15.000 L. En la fabricación de vacunas o en fermentaciones industriales (como la producción de bioetanol), pueden funcionar en paralelo varios biorreactores de más de 10.000 L.
Estos recipientes suelen ser de acero inoxidable, por su durabilidad y posibilidad de reutilización. A escala de producción, mantener condiciones uniformes en todo el volumen es un reto: los ingenieros aplican principios de escalado para conservar parámetros como la mezcla, la transferencia de oxígeno y otras condiciones comparables a las de escalas menores. A menudo, se utiliza una escala piloto intermedia (por ejemplo, un biorreactor de 100 L o 200 L) como paso previo entre la escala de banco y la producción completa, con el fin de asegurar que el proceso se comporta como se espera al aumentar el volumen.
Independientemente de la escala, los principios fundamentales son los mismos —igual que un kit casero de elaboración de cerveza y un tanque de fermentación industrial funcionan bajo el mismo concepto. Es importante destacar que escalar un proceso no consiste simplemente en hacer el tanque más grande; factores como la aportación de oxígeno, la agitación o la eliminación del calor se vuelven más complejos a medida que aumenta el volumen. Los ingenieros de bioprocesos dedican mucho esfuerzo a escalar biorreactores para que un cultivo celular que funcionaba en un recipiente de 2 L también lo haga correctamente en uno de 2.000 L. Afortunadamente, el uso generalizado de diseños estándar de tanque agitado permite que un proceso bien caracterizado pueda escalarse con resultados predecibles.
Conclusión
Los biorreactores son una tecnología fundamental en la era biotecnológica: nos permiten cultivar células a una escala útil, ya sea en pequeños volúmenes para investigación o en decenas de miles de litros para producción masiva. La elección del tipo de biorreactor y su configuración depende de muchos factores (el organismo utilizado, el producto que se desea obtener, los requisitos del proceso, consideraciones de coste, etc.), pero todos los biorreactores comparten un mismo objetivo: proporcionar un entorno ideal y controlado para que las células lleven a cabo reacciones bioquímicas.
Gracias a los avances en materiales, tecnología de sensores y automatización, los biorreactores se han vuelto más eficientes y especializados, impulsando la innovación en campos como la medicina, la alimentación, la energía y las soluciones medioambientales. Comprender los fundamentos de cómo funcionan los biorreactores y qué pueden hacer nos permite valorar lo esenciales que son estos sistemas, que a menudo operan silenciosamente en segundo plano, para ofrecer muchos de los productos y servicios que mejoran nuestra vida diaria. Los biorreactores son, sin duda, los motores que impulsan la biotecnología moderna, desde el laboratorio hasta la planta de producción.
Preguntas Frecuentes (FAQ)
Es un recipiente que proporciona un entorno controlado para el cultivo de células y microorganismos.
El recipiente, el agitador, el sparger, el control de temperatura, los sensores y las conexiones asépticas.
Diseños de tanque agitado, airlift, fotobiorreactor y de lecho empacado.
Los sistemas de un solo uso utilizan bolsas desechables sin limpieza, mientras que los de acero inoxidable son reutilizables y adecuados para grandes volúmenes.
Microorganismos, células de mamíferos e insectos, células vegetales y algas.
Referencias
Doran, P. M. (2013). Bioprocess Engineering Principles (2nd ed.). Academic Press.
Shuler, M. L., & Kargi, F. (2017). Bioprocess Engineering: Basic Concepts (3rd ed.). Pearson.
Stanbury, P. F., Whitaker, A., & Hall, S. J. (2016). Principles of Fermentation Technology (3rd ed.). Butterworth-Heinemann.
Harrison, R. G., Todd, P. B., Rudge, S. R., & Petrides, D. P. (2015). Bioseparations Science and Engineering (2nd ed.). Oxford University Press.
Eibl, R., Löffelholz, C., & Eibl, D. (2018). Single-Use Technologies in Biopharmaceutical Manufacture. John Wiley & Sons.
Enfors, S.-O., Jahic, M., Rozkov, A., Xu, B., Hecker, M., Jürgen, B., … Krull, R. (2001). Physiological responses to mixing in large-scale bioreactors. Journal of Biotechnology, 85(2), 175–185.
Posten, C., & Walter, C. (2012). Photobioreactors: Production systems for phototrophic microorganisms. Applied Microbiology and Biotechnology, 100(14), 6599–6614.
Barbosa, E. J., & Francisco, O. (2019). Advances in mammalian cell culture for vaccine production. Journal of Applied Microbiology, 127(2), 345–356.
U.S. Food and Drug Administration. (2015). Guidance for Industry: PAT – A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance. FDA.